वर्ष 1885 में नील्स हेनरिक डेविड बोर (Niels Heinrich David Bohr) का जन्म को डेनमार्क (Denmark) में हुआ, और वर्ष 1913 में नील्स बोर द्वारा रदरफोर्ड के परमाणु मॉडल (Rutherford’s atomic model) की त्रुटियों को दूर करते हुए तथा प्लांक के क्वाण्टम सिद्धांत (Planck’s quantum theory) की सहायता से अपना परमाणु मॉडल प्रस्तुत किया।
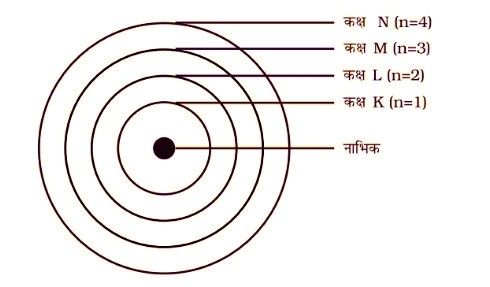
नील्स बोर के परमाणु मॉडल (Niels Bohr’s atomic model) के अनुसार इलेक्ट्रॉन (electrons) केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा (discrete orbit) कहा जाता है। इन कक्षाओं में चक्कर लगाने के लिए इलेक्ट्रॉन को ऊर्जा की आवयश्कता होती है, जिसे अपकेंद्रिय बल (centrifugal force) कहते हैं।
नाभिक के चारों ओर चक्कर लगाने वाले इलेक्ट्रॉन (electrons) तथा इसमें उपस्थित प्रोटॉन (protons) के कारण ही इनके मध्य आकर्षण बल उत्पन्न होता है, जिसे अपकेंद्रिय बल (centrifugal force) कहते है। इसी अपकेंद्रिय बल (centrifugal force) के कारण इलेक्ट्रॉन अपनी कक्षाओं में निरंतर गति करते रहते है।
अतः नील्स बोर के परमाणु मॉडल (Niels Bohr’s atomic model) से यह बात स्पष्ट होती है कि इलेक्ट्रॉन को अपकेंद्रिय बल (centrifugal force) नाभिक (nucleus) में उपस्थित प्रोटॉन (protons) के द्वारा ही प्राप्त होता है।
नील्स बोर के परमाणु मॉडल (Niels Bohr’s atomic model) के अनुसार इलेक्ट्रॉन (electrons), नाभिक (nucleus) के चारों ओर भिन्न-भिन्न कक्षाओं में वृत्ताकार पथ में गति करते हैं। भिन्न-भिन्न कक्षाओं में ऊर्जा का स्तर भी भिन्न-भिन्न होता है अर्थात् जो कक्षा नाभिक (nucleus) के समीप होगी उसमें ऊर्जा का स्तर सबसे कम तथा जो कक्षा नाभिक (nucleus) से सबसे दूर होगी उसमें ऊर्जा का स्तर सबसे अधिक होगा।
Note – नाभिक (nucleus) से दूरी बढ़ने के साथ-साथ कक्षाओं के ऊर्जा स्तर में भी वृद्धि होती जाती है।
रदरफोर्ड के मॉडल की कमी
अपने परमाणु मॉडल में रुदरफोर्ड यह सिद्ध नहीं कर पाएं की इलेक्ट्रॉन (electrons) अंनत समय तक अपनी ऊर्जा का निर्धारण कैसे करते है। इसका उल्लेख नील्स बोर ने अपने परमाणु मॉडल द्वारा किया –
इलेक्ट्रॉन (electrons) द्वारा गति करते समय परमाणु की कक्षाओं (orbitals) में ऊर्जा का निर्धारण होता है, जिससे इलेक्ट्रॉन (electrons) में तीव्रता उत्पन्न होती है। जिस कारण इलेक्ट्रॉन (electrons) में विकिरण को उत्सर्जन नही होता। अतः विकिरण का उत्सर्जन ना होने के कारण इलेक्ट्रॉन (electrons) नाभिक (nucleus) के भीतर नही गिर सकते।
नील्स बोर के परमाणु मॉडल कमियाँ (Niels Bore’s Atomic Model Drawbacks)
परमाणु (atom) में इलेक्ट्रॉन (electrons) के निरंतर गतिशील रहने के कारण ऊर्जा के स्तर में भी परिवर्तन होता रहता है, जिससे इलेक्ट्रॉन (electrons) की कक्षाओं (orbits) में भी परिवर्तन होता रहता है। इलेक्ट्रॉन (electrons) की कक्षाओं (orbits) में परिवर्तन के कारण स्पेक्ट्रम रेखाओं (Spectrum lines) का सृजन होता है।
चुम्बकीय क्षेत्र (magnetic field) के कारण इन स्पेक्ट्रम रेखाओं (Spectrum lines) में विभाजन होता है, जिसे “ज़ीमान प्रभाव (Ziemann effect)” कहलाता है।
विद्युत प्रभाव वाले क्षेत्र में स्पेक्ट्रम रेखाओं (Spectrum lines) में विभाजन होने की क्रिया से पड़ने वाले प्रभाव को “स्टॉर्क प्रभाव (stork effect)” कहते हैं।
नील्स बोर के परमाणु मॉडल द्वारा ज़ीमान प्रभाव (Ziemann effect) व स्टॉर्क प्रभाव (Stork effect) दोनों को परिभाषित नहीं किया जा सकता।
Note: नील्स बोर के परमाणु मॉडल (Niels Bohr’s Atomic Model) को रदरफोर्ड-बोर परमाणु मॉडल (Rutherford – Bohr atom model) भी कहा जाता है, क्योंकि यह काफी हद तक रदरफोर्ड के परमाणु मॉडल से मिलता जुलता है।

Which books write with Niels bohr
❤️❤️
Achha hai notes sir
Good ❣️❣️